La observación de cualquier material al microscopio requiere de un pequeño equipo que no es difícil de obtener bien adquiriéndolo por Internet o en muchas tiendas de Óptica.
PORTAOBJETOS Y CUBREOBJETOS
Cualquier objeto que se quiera observar debe colocarse sobre unos cristales transparentes, rectangulares y finos, de un grosor no superior a 2 mm.
Toda gota de líquido tiende a adquirir la forma hemisférica o cóncava cuya superficie es muy reflectante de la luz por lo que es necesario “aplastarla” con un fino cristalito, el cubreobjetos que es un cuadrado o rectángulo de 1 a 2 cm de lado los más usuales y extremadamente fino, en general menos de 0,2 mm.
Cubreobjetos
PINZAS
Como el material que se usa para observar debe ser siempre muy pequeño nuestros dedos son muy gruesos y pegajosos para manejar los cortes y pequeñas muestras por lo que es necesario disponer de unas pinzas de hierro con punta fina rectas o curvas.
AGUJAS ENMANGADAS
Por las mismas razones que se requiere el uso de pinzas también es necesario el uso de agujas, en unos casos para tomar pequeñas muestras, para manejarlas sobre el portaobjetos, para removerlas en los líquidos de observación y en los colorantes, para ayudar a montar las preparaciones y en general para muchas aplicaciones.
Para la realización manual de cortes microscópicos las mejores cuchillas y más económicas son sin duda las antiguas cuchillas de afeitar con filo biselado y recto. Por supuesto también pueden servir otro tipo de cuchillas como las de barbero o las de los bisturís, aunque estas últimas suelen ser curvas y resultan menos prácticas.
PAPEL SECANTE
Para la limpieza de portaobjetos e incluso de cubreobjetos y sobre todo para la limpieza de las preparaciones, eliminación de los líquidos sobrantes y para los lavados de colorantes es necesario el uso de papel absorbente que puede ser papel secante, papel de cocina, toallitas o incluso papel higiénico doméstico. En todos los casos utilizan material de buena calidad, especialmente en el caso de papel higiénico ya que de lo contrario pueden soltar fibras que ensucian o contaminan las preparaciones.
LENTES DE AUMENTO
Para la manipulación del material y sobre todo para la realización manual de las secciones microscópicos es muy útil el uso de una lupa que disponga de sostenimiento propio para que nos deje libres las manos para la manipulación del material, bien sea una lupa con brazo telescópico, una lupa de mesa con pie flexible o idealmente una lupa de las que se acoplan a las gafas y que se pueden adquirir en cualquier tienda de Óptica. La graduación no tiene que ser excesiva pero cada uno debe probar la que mejor le va.
Lupa de mesa con brazo telescópico
Lupa para adaptación a gafas
Lupa con gafas acopladas
COLORANTES Y REACTIVOS
En Micología existen una gran variedad de colorantes y reactivos que con más o menos interés son de gran utilidad en la observación de preparaciones microscópicas de hongos y para ello recomiendo la gran obra de Basso o la de la Asociación Micológica Bresadola, algunos de ellos son de utilidad más frecuente y otros solo de utilidad muy puntual para destacar aspectos concretos de algunas especies.
En nuestro caso y por sencillez voy a mencionar simplemente los colorantes y reactivos que salvo ocasiones muy excepcionales uso habitualmente.
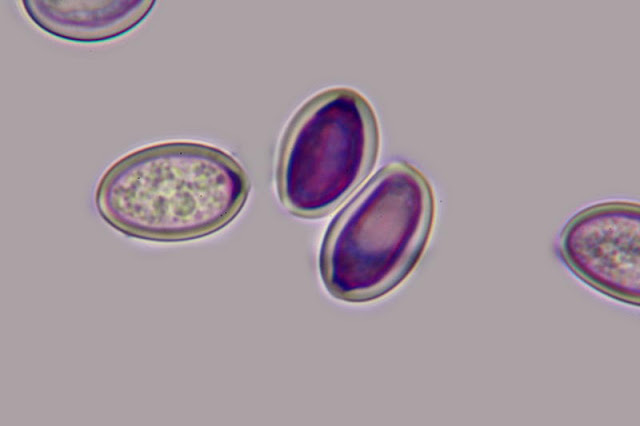
1. AGUA. Inicialmente y casi de manera general para todas las preparaciones usamos como primer medio de observación AGUA del grifo ni destilada ni salina, lo más parecida al medio en el que viven los hongos.
Esporas en agua de Cortinarius cinnabarinus
2. POTASA al 5 % en agua. En el caso de cutículas de sombrero y en la observación de algunas esporas utilizamos este medio porque percibimos que resalta mejor los pigmentos y en algunos casos, sobre todo de esporas y cistidios, da reacciones con el contenido celular de especial interés.
Cutícula de Cortinarius fluryii en potasa
3. ROJO CONGO muy diluido, al 0,1% en agua o también en amoniaco con el material seco. La mayor parte de las preparaciones terminamos observándolas en este colorante porque destaca bien las paredes celulares, en algunos casos (congófilas) también sus contenidos celulares y da una coloración de contraste muy aceptable para la fotografía.
Cistidios de Inocybe flocculosa en rojo congo
4. HIDRÓXIDO DE AMONIO al 10 % en agua. El material seco o de exsicata lo observamos inicialmente en este medio que facilita la rehidratación y destaca los pigmentos o directamente en rojo congo amoniacal.
5. HIDRATO DE CLORAL al 50% en agua. Útil para la observación de materiales desecados o exsicatas, se deja unos minutos el material en el medio para que se rehidrate y luego se observa en el mismo medio.
6. MELZER. El reactivo Melzer a base de yodo y que lo preparamos disolviendo en 20 cc de agua 2 gr de ioduro potásico, 0,5 g de yodo y 1 g de hidrato de cloral ya preparado. Este medio se utiliza para comprobar la presencia de almidón o glucógeno en esporas, ascas o en cualquier otra parte del hongo y es especialmente útil en el caso de Ascomicetos. Para comprobar la amiloidad de las esporas de Basidiomicetos utilizamos el reactivo o simplemente LUGOL ( Melzer sin hidrato de cloral) directamente sobre las esporadas y se observa a simple vista.
Distintas fotos de esporas de Russula fragilis en Melzer
Esporas de Lactarius pterosporus con crestas amiloides, en Melzer
7. AZUL COTON al 0,1 % en ácido láctico oficinal, lactofenol o agua (mejor comprarlo hecho). Colorea muy fuertemente las paredes y algunas estructuras de esporas y cistidios en los casos de esporas o cistidios cianófilos.
8. FUCHSINA BÁSICA (mejor comprar el reactivo preparado). Realmente imprescindible para el estudio de muchas especies del género Russula ya que permite poner en evidencia la presencia de ciertas sustancias en algunas hifas de la cutícula, las llamadas hifas primordiales. Este colorante en el plazo de unos 5 minutos tiñe intensamente de azul toda la preparación, luego con cuidado de no arrastrar la muestra se lava con agua gota a gota sobre el portaobjetos inclinado o se enjuaga la sección de cutícula en agua hasta que deje de soltar colorante. A continuación se vierte una gota de Acido clorhidrico al 5% en agua y se deja 1 a 2 minutos, se aprecia cómo decolora la mayor parte del colorante, y a continuación se vuelve a lavar con agua la preparación para frenar la acción del ácido y se observa en la misma agua.
Hifas primordiales de cutícula de Russula pseudointegra observadas con incrustaciones acidoresistentes
9. AZUL DE CRESOL. Este reactivo conviene prepararlo al momento de utilizar, sobre una gruesa gota de agua sobre el portaobjeto se pone un poco de polvo de azul de cresol con la punta de una aguja enmangada, se remueve para disolverlo y ya se puede poner el objeto a observar, fundamentalmente utilizado para evidenciar el poro germinativo de algunas esporas (Lepiota y Macrolepiota), reacción metacromática, se deja actuar durante un par de minutos y se pone el cubreobjetos. Para un mejor contraste se recomienda lavar la preparación con agua a base de arrastrar unas gotas de agua puestas al borde del cubreobjeto y aspiradas del otro lado con un papel secante (con cuidado de no arrastrar también las esporas).
Esporas de Macrolepiota mastoidea en azul cresol
10. CARMÍN ACÉTICO (recomendamos comprarlo preparado). Algunos elementos de ciertos hongos, como basidios de Calocybe, Lyophyllum y otros Agaricales contienen gránulos que se tiñen intensamente con este reactivo, carminófilos. Se coloca una porción de material a observar sobre el portaobjetos y en una gruesa gota del reactivo, se calienta suavemente, retirando constantemente el fuego para evitar que hierva y se va añadiendo nuevo reactivo para evitar que se deseque del todo, tras aproximadamente un minuto de calentamiento se retira el material y se pone para su observación en otra gota de reactivo fresco.
Basidios y basidiolos carminófilos de Calocybe gambosa
11. SULFOVANILINA. Se trata de un reactivo microquímico más que un colorante para poner en evidencia la presencia en el interior de algunos cistidos, basidios o hifas laticíferas sobre todo Russuláceas de ciertas sustancias que se ponen grisáceas o azuladas. Es conveniente hacer el preparado al momento ya que es muy caduco. Sobre un vidrio se coloca una gota de ácido sulfúrico puro o al 50% (tener cuidado con su manipulación) y con una aguja de hierro se echan unos cristalitos de vanillina que se disuelven rápidamente, se coloca el material a observar y se revuelve un poco para que evapore el agua de la reacción y se observa en el mismo reactivo.
Dermatocistidios grisáceos de Russula persicina en sulfovanilina
12. SULFOBENZALDEHIDO. Este reactivo que sirve para los mismo fines que el anterior y también es recomendable prepararlo al momento, una gota de benzaldehído se mezcla con otra de ácido sulfúrico al 70 a 80 %, y con el mismo procedimiento se coloca el material de observación, se revuelve y se deja escapar el agua y se observa en el mismo reactivo
Dermatocistidios de Russula heterophylla y Russula faginea en sulfobvenzaldehido
13. AGUA GLICERADA al 20 %. En algunas ocasiones, especialmente con la observación de esporas y capillicios de Gasteromicetos el material es muy hidrófobo y se forman muchas burbujas sin que las esporas lleguen a impregnarse de agua, en estos casos este medio se comporta mejor que la propia agua
Esporas de Bovista plumbea observadas en agua glicerada
MONTAJE DE PREPARACIONES
Salvo algunos materiales que de por sí contienen mucho líquido y por tanto son muy refringentes, todos los materiales que se quieran observar con un microscopio deben observarse inmersos en un líquido de observación, incoloro o coloreado, pero obviamente transparente. La razón es que todos los objetos son muy poco refringentes y tienden a reflejar la luz y por tanto aparecen muy oscuros por lo que hay que sumergirlos en un líquido que facilite el paso de la luz, por tanto se deben colocar inmersos en un líquido de observación.
Paso a paso:
1. Disponer de una muestra de material suficientemente pequeña o con la ayuda de una cuchilla realizar una sección lo suficientemente delgada para que deje pasar la luz que viene de abajo del microscopio. (Var apartado “Técnicas de cortes”).
2. Con la ayuda de la aguja enmangada o de unas pinzas finas disponer la porción o los cortes sobre el centro de un cristal portaobjetos (procurar siempre no dejar huella de dedo).
3. Añadir una gota de líquido de observación o de colorante. Con la aguja enmangada remojar bien la muestra para que salga todo el aire y dejar uno o varios minutos para que se coloree adecuadamente en caso de usar colorante.
4. Tomar un cristal cubreobjetos (por los bordes y sin dejar huella digitales) y apoyarlo a un lado de la gota de observación donde está inmerso el material y con ayuda de la aguja enmangada dejar caer despacio el cristal evitando la formación de burbujas.
5. Con la parte roma de la aguja enmangada, con la parte trasera de un bolígrafo, con la uña o con cualquier otro objeto romo y que no deje huella (nunca con el dedo) presionarlo ligeramente para que salga el líquido sobrante. En una primera observación “no” es conveniente presionar mucho el cubreobjetos para observar su estructura y diferentes capas que presenta la muestra, sin embargo para la observación detallada de los elementos que componen, hifas, fíbulas, cistidios, laticíferos, etc, se procederá a realizar un posterior “escachado” del material presionando el cubreobjetos con un instrumento romo, que puede ser la parte trasera de la aguja enmangada o de un bolígrafo, nuestra uña o mejor una “goma de borrar” comprimir el cubreobjeto para escachar el material, con precaución de no romper el cristalito de cubreobjetos.
6. Si la muestra es demasiado gruesa (lo que no es bueno) o la cantidad de líquido de observación que hemos puesto es escasa nos quedará aire entre los dos cristales que nos impedirá ver adecuadamente ya que el aire siempre se ve negro, en este caso habría que repetir la preparación con unas muestras más finas o añadir más líquido de observación por los bordes hasta que salga todo el aire.
7. Con cuidado eliminar el líquido de observación sobrante por los bordes con el uso de un papel secante.
Cuando usamos colorantes toda la preparación aparece muy coloreada, para un mejor contraste del objeto a observar, más limpieza del medio y sobre todo cuando se quieren realizar fotografías es recomendable lavar el máximo posible de colorante y dejar solo coloreado las muestras de material.
1. Utilizando el mismo gotero del agua de observación poner una gruesa gota en un borde del cubreobjetos y con un papel secante absorber desde el otro lado.
2. Con la aguja enmangada levantar ligeramente el cubreobjetos desde el lado donde se ha puesto la gota de agua para facilitar su penetración.
3. Repetir este proceso cuantas veces sea necesario para disponer de una preparación nítida y volverla a repetir si se ha hecho posteriormente un “escachado” para la observación de estructuras y con el fin de eliminar tanto colorante como material intracelular y extracelular que suelta al desmenuzar el tejido.
4. Si se quiere teñir las propias muestras observadas en agua o potasa o incluso excepcionalmente se quiere proceder a una segunda coloración con el mismo u otro colorante colocar una gota de colorante en el borde del cubreobjetos y proceder como con el lavado, absorberlo desde el otro lado y con la aguja enmangada levantar ligeramente el cristal para facilitar la penetración del colorante. Después proceder nuevamente a un lavado normal como el descrito anteriormente.
TÉCNICAS DE CORTES PARA PREPARACIONES MICROSCÓPICAS
La observación al microscopio exige que los materiales que se van a observar sean los suficientemente delgados para que la luz los atraviese ya que el microscopio a diferencia de la lupa utiliza la luz refractada, es decir que atraviesa el objeto, mientras la lupa utiliza luz reflejada que viene de arriba y rebota en el objeto. Esto exige que se tomen muestras muy diminutas o que se hagan secciones o cortes muy finos que permitan el paso de la luz.
TECNICAS DE CORTES TRANSVERSALES
Para los cortes transversales las técnicas más sencillas que hemos utilizado son básicamente dos:
- Disponer la fina tira de material que se va a seccionar sobre un cristal portaobjetos de microscopio, se sujeta por un extremo con la punta del dedo y con una cuchilla de las antiguas de afeitar, mejor que con una cuchilla de bisturí, apoyada en el mismo dedo se realizan varios cortes que dejen fino “hilos” del material.
- También se pueden utilizar dos cuchillas juntas y aprovechando el bisel del corte simplemente llevar a cabo un corte transversal de la tira de material y con la punta de una aguja retirar el fino hilo que quedará adherido al corte de la cuchilla.
En caso de materiales muy opacos y duros, como algunos estromas de Ascomicetos, la observación de su estructura es muy complicada y en estos casos se requiere de equipos especiales y más profesionales.
Para realizar estos cortes es recomendable utilizar una simple lupa provista de brazo flexible o mejor unas lentes de aumento (más o menos según el gusto de la persona) que se acoplan a las gafas normales, ambas cosas pueden adquirirse en una tienda de Óptica.
A continuación describiremos la técnica utilizada por nosotros para la observación de las distintas partes de un carpóforo o seta:
CARNE O TRAMA
Para la observación de la carne interna del sombrero o del pie no siempre es necesario realizar un corte fino sino simplemente con la punta de una aguja tomar una pequeña porción de la carne, colocarla sobre un portaobjetos añadir el medio de observación que se vaya a utilizar y colocar el cubreobjetos y proceder al escachado explicado anteriormente.
En los casos que nos interese conocer la estructura o disposición de las hifas se procedería a realizar un corte transversal y proceder como se ha explicado anteriormente
CUTÍCULA SOMBRERO
Con una cuchilla se retira una fina tira de la superficie del sombrero de no más de 2 a 3 mm de anchura hacia la mitad del radio y en sentido transversal. En los casos que lo permita se puede obtener simplemente arrastrando la piel, como pelando la seta.
Esta tira se lleva a un cristal de un portaobjeto y se procede a separar una pequeña porción si solo se quiere realizar una observación frontal de la cutícula o a realizar secciones transversales de la fina banda de manera que respondan a vistas radiales de la cutícula.
A continuación se vierte el medio de observación o el colorante, se tapa con el cubreobjetos y en caso de utilizar colorante es recomendable lavar el colorante sobrante con agua a partir del borde del cubreobjetos.
Al principio no escachar mucho las secciones para observar la estructura y disposición de las distintas capas y luego escachar para ver por separado los distintos elementos.
Es también conveniente hacer una primera observación en agua o potasa para ver la presencia de pigmentos y su disposición y posteriormente realizar la observación con algún colorante para destacar mejor las estructuras. En la mayoría de los casos se puede utilizar la misma preparación poniendo el colorante al borde del cubreobjetos y facilitando con un papel secante su absorción o levantando ligeramente el cristal con la punta de la aguja para facilitar la penetración del colorante, dejar unos minutos para que se coloreen los cortes y posteriormente proceder al lavado de la preparación como se ha explicado anteriormente.
CUTÍCULA PIE
En general es más fácil que la del sombrero, se extrae una fina tira longitudinal del pie, que según los casos o intereses de observación puede tomarse de la parte superior, de la parte media o de la parte baja del pie y a continuación con la cuchilla se realizan unos finos cortes longitudinales que nos muestren la estructura transversal de la cutícula de arriba abajo.
A continuación proceder como con la cutícula, observar primero en agua o potasa sin presionar demasiado y posteriormente añadir colorante y presionar más para separar sus elementos, lavar y observar.
LAMINAS
La observación de las láminas exige la realización de un corte transversal de la lámina y muy convenientemente una sección de la arista o borde externo de la lámina.
Para la realización del corte transversal se separa una lámina del carpóforo, se coloca sobre un cristal portaobjetos y con la técnica explicada anteriormente se procede a realizar tres o cuatro finos cortes, se eliminan los más gruesos, los más deteriorados o en general los que peor nos hayan salido y dejamos un par para la observación.
Aunque nos lleva más tiempo yo recomiendo observar los cortes primero con agua o potasa para ver mejor la estructura general y presencia de pigmentos en algún elemento y posteriormente y sobre la misma muestra añadir un colorante, desde el borde del cubreobjetos arrastrándolo con un papel secante desde el extremo opuesto. Se deja que se tiña y luego se lava de igual manera con agua.
Una vez observada la estructura como en otros casos se procede a escachar la preparación con cuidado, separar los elementos, lavarlos nuevamente y observarlos.
Los elementos más destacables de una lámina himenial en general se disponen en las superficies externas, tanto las caras como las aristas.
Para la observación de los elementos de la arista, aunque pueden apreciarse un único punto en un corte transversal como el descrito es mejor realizar un corte longitudinal muy fino de todo el borde de la lámina, separar así la arista, proceder como en el caso anterior y tener ocasión de observar una buena porción de arista con todos sus elementos.
TUBOS Y AGUIJONES
Por la morfología diferenciada del himenio de Boletales e Hydnáceas las técnicas de observación tienen que ser algo diferenciadas.
En el caso de los Boletus en sentido general yo recomiendo realizar dos tipos de cortes, uno transversal y otro longitudinal. Cortar un paralelepídeo de himenio de no más de 2 mm de anchura, colocarlo sobre un portaobjetos y sujetando con el dedo realizar finas secciones transversales para observar la luz de los tubos y la disposición de sus elementos en relación a la sección de los tubos.
También proceder a realizar una sección longitudinal del himenio, recortar finos hilos todo lo largo del tubo que se hacen más fácilmente y permiten ver los elementos en una mayor amplitud de tubo himenial
En ambos casos y dada la textura muy blanda de este himenio al principio en una primera observación hay que presionarlos muy poco y luego como en las láminas llevar a cabo una expansión del material para observar los elementos por separado.
En el caso de los aguijones resulta relativamente fácil obtener secciones transversales de los aguijones, pequeños discos que cortados a distintas alturas nos dan una visión bastante adecuada de la disposición de los distintos elementos a lo largo del aguijón. Mucho más complicado es obtener una sección longitudinal salvo en caso de gruesos aguijones.
VELO GENERAL O PARCIAL Y OTROS ELEMENTOS
En el caso de otras estructuras como los restos de velo general o parcial, tales como escamas del sombrero, anillo, volva, etc, hemos procedido igual que con la carne, tomando una pequeña muestra, contra más pequeña mejor se va a observar, colocarla en el portaobjetos con el medio de observación que vayamos a utilizar (agua o directamente un colorante como el rojo congo) y colocar el cubreobjetos haciendo un poco de presión para extender la muestra y posteriormente con papel de filtro eliminar el líquido sobrante.